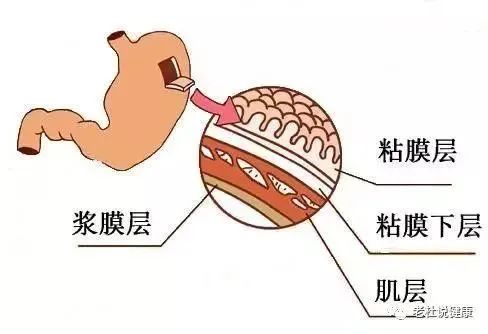
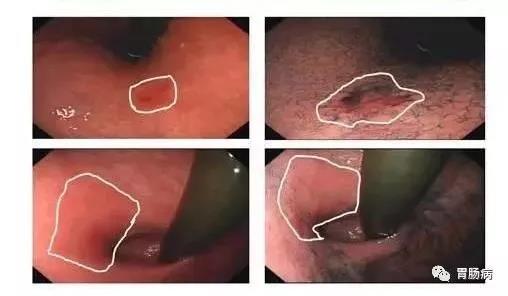
随着医学技术的日新月异,治疗胃癌的手段越来越多,我们患者要进行的选择,要了解的知识点也越来越多。至于术后要不要做化疗,相信也是大部分患者都在纠结的问题。毕竟化疗在我们的印象中都与脱发、呕吐种种可怕的副作用联系在一起,令人心生抵触。 今天就来和大家从四个方面聊聊关于胃癌术后的辅助化疗的问题,让大家的化疗做得明明白白。 问题一 为何胃癌手术后还要做辅助化疗? 在了解辅助化疗之前,大家可以先想一个问题:如果我在大型医院,做完胃癌根治手术,医生说手术很成功,又做完了全套的肿瘤筛查,CT、增强CT、胃镜、肿瘤标志物等等,最后显示的结果是身体内没有肿瘤了,那就是百分之百的说明我们的体内没有肿瘤了嘛? 这是未必的。手术只属于局部治疗,只能切除可见的癌细胞和癌组织,对于已经通过血液循环、淋巴系统等转移的癌细胞并不能清除,而且,很可能我们已经有了“微灶转移”,只是以现在的检查手段查不出来而已。那这些没被查出来的、甚至是“莫须有”的小问题可以不管了吗?肯定是不可能的。 目前,胃癌属于术后复发率比较高的一类癌症,一些综合数据都显示,胃癌根治术后大概有半数的患者会复发转移。面对这种高复发的状况,如果我们想要防微杜渐,就要把概率上可能有转移的患者都拉过来,做一遍预防性的化疗,这是最稳妥的。这也就是我们所说的辅助化疗。 之所以倾向于化疗,是因为比起很多局部作用的治疗方式,化疗是一种全身治疗的方式,化疗药物能随着血流到达全身各处,杀死转移到身体其他部位、边边角角的癌细胞,它可能错杀但绝不会放过我们的癌细胞。 问题二 辅助化疗和新辅助化疗的差别? 化疗的分类有很多,经常有人弄不清辅助化疗和新辅助化疗有什么差别。最简单的来说,新辅助化疗都是在手术前做的,辅助化疗都是手术后做的。 对于大部分胃癌患者,新辅助治疗的主要目的是使瘤体降期,使肿块缩小、及早杀灭看不见的转移细胞,以利于后续的手术、放疗等治疗。新辅助化疗一般是可以2到3次为一个疗程。只要通过新辅助治疗达到了预期的缩瘤效果,就可以开始进入下一步治疗了。 术后辅助化疗的主要目的是消灭术后残留的癌细胞,抑制亚临床病灶,防止术后复发转移,从而提高进展期胃癌的生存率,为患者带来了更多生存获益。胃癌术后的辅助化疗一般是在手术后4~6周开始,在术后半年内完成。如果是3周一个疗程,一般要做到6~8次;2周一个疗程,一般会做到10~12次。 问题三 哪些人术后需要辅助化疗? 谈了这么多,那么哪些人建议做辅助化疗呢?目前,胃癌术后是否需要辅助化疗主要是根据胃癌的分期来决定的。想要知道自己是否需要术后化疗,我们首先就要了解自己的分期。 目前国际公认的胃癌分期主要采用TNM标准,即分T、N、M三部分评估。 T分期是看肿瘤大小及侵犯深度: T0期:无原发肿瘤证据 T1期:胃部肿瘤已侵犯黏膜层 T2期:侵犯肌层 T3期:侵犯浆膜层 T4期:突破浆膜层侵犯周围器官 N分期是看淋巴结分期,目前胃癌是根据淋巴结转移个数进行N分期的。 N0:无淋巴结转移 N1:转移1-2颗淋巴结是N1 N2:转移3-6颗的淋巴结 N3:转移7颗以上的淋巴结 M分期代表的是远处转移分期。 M0:没有转移 M1:有转移 一般说来,如果单看“T”,T1期肿瘤浸润深度仅限于粘膜下层,术后是不用化疗的。这种情况下整体预后较好,化疗并不能使患者明显生存获益,反而增加了毒性反应的可能。 T2的患者如果没有合并有危险因素(比如肿瘤低分化、脉管癌栓、神经侵犯、年龄小于50岁、未行根治性D2淋巴结清扫等等),也可以考虑定期复诊,而不是直接进行辅助化疗。 T 3、T4的患者,如果胃癌肿瘤浸润深度超过粘膜,达到固有层或肌肉层以上(T 3、T4)。无论是否合并其他危险因素,都应进行化疗。 但不论是T1还是T4的患者,是否要化疗,还有两个决定性因素,只要符合任何一种,就需要后续的辅助治疗。 第一是转移(N、M),不论是发生了淋巴结转移还是术后查出新的远处转移,都是需要进行辅助化疗。即使是局限于T1、T2的早期胃癌,只查出一两个淋巴结转移,也需要富足化疗。因为但凡有了转移,我们就认定手术后依旧有较大的可能性在体内残留癌细胞并导致日后的复发及转移。 第二是手术后病理结果提示,手术切缘呈阳性。这就代表了手术没切干净,还有肿瘤残留。很显然这时候我们还需要“补救”一下,这种情况下,我们除了接受辅助化疗外,还需要追加术后局部放疗等治疗手段,以求尽可能多的杀灭残留的肿瘤、控制肿瘤进展。 列了这么多情况,简而言之就是一句话,T1、以及部分T2没有高危因素的患者,如果没有淋巴结、远处转移,手术又成功“切干净”了,那可以不做后续的辅助治疗。除此之外,即便不选择辅助化疗,一般也建议患者进行后续其它的辅助治疗,以降低复发风险。 很多人说,我做的不是根治性手术,只是姑息性手术,那还需要术后化疗吗?出于降低胃癌的复发率,减少肿瘤发生远处转移风险的目的,也是要做的。 问题四 术后辅助化疗,对胃癌患者有多大作用? 很多人都想弄明白,手术后做了近半年辅助化疗,承受了这么大副作用,那我的复发率大概能降低多少呢? 目前,我们的循证医学给出了许许多多的临床证据来证明,上面所罗列的这几种分期的胃癌患者做化疗是利大于弊的。下面也整理了一些胃癌辅助化疗常用药的临床数据。 我们可以看到S-1(替吉奥)的III期临床试验(ACTS-GC)。这个临床试验纳入了超过1000例以上的胃癌术后II期和III期的患者,让他们在手术后随即按照1:1的比例分入S-1(替吉奥)组和不化疗组,而后进行为期数年的跟踪调查。其结果显示,从整体上看:胃癌II期及III期患者术后化疗都可以提高约一成的五年生存率及5年无复发率。S-1(替吉奥)组VS无辅助化疗组的5年生存率为71.7%、61.1%,5年无复发生存率为65.4%、53.1%,具体数据可见下图: 值得强调的是,II期胃癌患者,属于S-1(替吉奥)获益最明显的人群,辅助化疗后5年生存率可提升12.9%(84.2%VS71.3%),5年无复发生存率可以提升14.8%(79.2 VS 64.4%),见下图: 除此之外,曾经INT0116研究中也比较过单纯手术和术后5-Fu(5-氟尿嘧啶)同步放化疗的差异。结果显示,术后辅助放化疗组患者的中位生存期(36个月 vs. 27个月)及无病生存期(30个月 vs. 19个月)均显著优于单纯手术组。 从这两个试验我们能看出,不论是从生命周期还是从复发概率上看,术后进行合理、对症的化疗都能有不错的效果。 当然了,这里还要说明一下,之所以拿替吉奥和5-氟尿嘧啶做例子,不是因为它们的效果特别优异,建议胃癌患者都选择它们。用于胃癌术后辅助治疗的药物很多,这里只是拿我们比较熟悉,临床试验样本量也比较大的药举个例子而已。大家在选择辅助化疗时最重要的还是“对症用药”。 另外,辅助化疗不仅有单药治疗,也有双药治疗、三药治疗,以及与靶向治疗、放射治疗的联合,这些方式也都能为患者争取更大的收益。在这里篇幅有限,如果有兴趣,我们可以之后继续展开再讲。 参考文献 Sasako M, Sakuramoto S, Katai H, Kinoshita T, Furukawa H, Yamaguchi T, Nashimoto A, Fujii M, Nakajima T, Ohashi Y: Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J Clin Oncol 2011, 29(33):4387-4393. Bang YJ, Kim YW, Yang HK, Chung HC, Park YK, Lee KH, Lee KW, Kim YH, Noh SI, Cho JY et al: Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet (London, England) 2012, 379(9813):315-321. Yoshida K, Kodera Y, Kochi M, Ichikawa W, Kakeji Y, Sano T, Nagao N, Takahashi M, Takagane A, Watanabe T et al: Addition of Docetaxel to Oral Fluoropyrimidine Improves Efficacy in Patients With Stage III Gastric Cancer: Interim Analysis of JACCRO GC-07, a Randomized Controlled Trial. J Clin Oncol 2019, 37(15):1296-1304. Zhang X, Liang H, Li Z, Xue Y, Wang Y, Zhou Z, Yu J, Bu Z, Chen L, Du Y et al: Perioperative or postoperative adjuvant oxaliplatin with S-1 versus adjuvant oxaliplatin with capecitabine in patients with locally advanced gastric or gastro-oesophageal junction adenocarcinoma undergoing D2 gastrectomy (RESOLVE): an open-label, superiority and non-inferiority, phase 3 randomised controlled trial. Lancet Oncol 2021, 22(8):1081-1092. Lee J, Lim DH, Kim S, Park SH, Park JO, Park YS, Lim HY, Choi MG, Sohn TS, Noh JH et al: Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial. J Clin Oncol 2012, 30(3):268-273. Wang ZX, Li GX, Zhou ZW, Huang ZP, Wang F, Xu RH: Validation of a nomogram for selecting patients for chemotherapy after D2 gastrectomy for cancer. The British journal of surgery 2017, 104(9):1226-1234. Park SH, Zang DY, Han B, Ji JH, Kang WK: ARTIST 2: Interim results of a phase III trial involving adjuvant chemotherapy and/or chemoradiotherapy after D2-gastrectomy in stage II/III gastric cancer (GC). Journal of Clinical Oncology 2019, 37(15_suppl):4001-4001. Conversion Therapy For Gastric Cancer: Expanding The Treatment Possibilities. www.ncbi.nlm.nih.gov/pmc/ articles/PMC6488271/#!po=10.0000 胃癌诊疗规范(2022年版) https://www.mayoclinic.org/diseases-conditions/stomach-cancer/diagnosis-treatment/drc-20352443